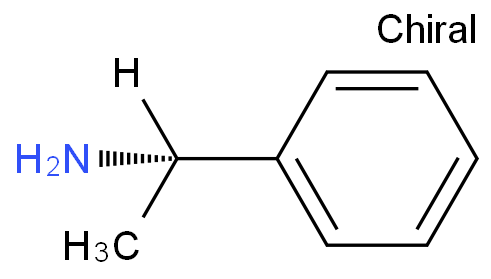
L-α-苯乙胺;S-(-)-α-甲基苄胺
更新时间:2022-04-27
编辑次数:1次
编辑者:A居然唯庭装饰.李明浩
中文名
L-α-苯乙胺;S-(-)-α-甲基苄胺
英文名
L(-)-Alpha-Methylbenzylamine
别 名
S(-)-alpha-甲基苄胺;S(-)-A-甲基苄胺
CAS
2627-86-3
化学式
C8H11N
分子量
121.187
密 度
0.94
沸 点
183.007°C at 760 mmHg
EINECS
220-098-0
闪 点
75.803°C
信号词
警告
危害声明
H302-H311-H314
警示性声明
P280-P305 + P351 + P338-P310
危险品运输编码
UN 2735
包装等级
III
危险类别
海关编码
29214980
外观性状
透明液体。
稳定性
如果遵照规格使用和储存则不会分解。
储存条件
在氮气气氛下可长期保存。
主要用途
1、手性α-甲基苄基胺的两个对映异构体在不对称合成中具有重要的地位。一方面该化合物可以大规模地商品化,是一个手性源化合物。另一方面,它独特的苄胺结构可以方便地发生脱苄基反应。因此成为一个重要的手性辅助合成试剂。
2、手性α-甲基苄基胺最成熟的功能之一是对外消旋羧酸的手性拆分。将该化合物与外消旋羧酸在合适的溶剂中搅拌,生成一对非对映异构体的混合物。由于两者的物理性质不同,例如:溶解度不同,许多时候其中的一个对映异构体会自动从溶剂中结晶出来。如果选用合适的溶剂进行分步结晶,有时会得到非常理想的分离效果。
3、手性α-甲基苄基胺也常常用于不对称反应中对映异构体纯度的鉴定。通过与所测定的对映异构体混合物反应引入一个新的手性中心,得到一对非对映异构体。这样就可以简单地通过NMR的方法来了解不对称反应的对映体选择性能力 。
4、手性α-甲基苄基胺最大的用途是作为手性合成反应的辅助试剂,它利用自身的手性在反应中诱导或者控制产物的立体化学。待反应完成后,利用氢解反应脱去苄基。在这些情况下,试剂分子中的氮原子留在了产物的分子中,成为合成手性含氮化合物最惯用的策略。环氧化合物的手性开环氨基化反应是该试剂参与的一个重要反应。
5、手性α-甲基苄基胺与适当的羰基生成手性亚胺后参与的一些反应也是合成手性氮环化合物的重要方法。例如:手性亚胺与二烯进行杂原子Diels-Alder (D-A) 反应生成手性氮环化合物,然后脱去苄基得到理想的产物 (式4)。手性亚胺也可以用于其它类型手性化合物的合成 (式5)[7~9]。但是,手性α-甲基苄基胺作为手性辅助试剂有一个致命而且不能克服的缺点,就是被诱导的产物的对映异构体纯度一般不高。原因在于该试剂结构的本质,因为在与氨基相连的手性碳原子周围缺乏合适的空间位阻 。
2、手性α-甲基苄基胺最成熟的功能之一是对外消旋羧酸的手性拆分。将该化合物与外消旋羧酸在合适的溶剂中搅拌,生成一对非对映异构体的混合物。由于两者的物理性质不同,例如:溶解度不同,许多时候其中的一个对映异构体会自动从溶剂中结晶出来。如果选用合适的溶剂进行分步结晶,有时会得到非常理想的分离效果。
3、手性α-甲基苄基胺也常常用于不对称反应中对映异构体纯度的鉴定。通过与所测定的对映异构体混合物反应引入一个新的手性中心,得到一对非对映异构体。这样就可以简单地通过NMR的方法来了解不对称反应的对映体选择性能力 。
4、手性α-甲基苄基胺最大的用途是作为手性合成反应的辅助试剂,它利用自身的手性在反应中诱导或者控制产物的立体化学。待反应完成后,利用氢解反应脱去苄基。在这些情况下,试剂分子中的氮原子留在了产物的分子中,成为合成手性含氮化合物最惯用的策略。环氧化合物的手性开环氨基化反应是该试剂参与的一个重要反应。
5、手性α-甲基苄基胺与适当的羰基生成手性亚胺后参与的一些反应也是合成手性氮环化合物的重要方法。例如:手性亚胺与二烯进行杂原子Diels-Alder (D-A) 反应生成手性氮环化合物,然后脱去苄基得到理想的产物 (式4)。手性亚胺也可以用于其它类型手性化合物的合成 (式5)[7~9]。但是,手性α-甲基苄基胺作为手性辅助试剂有一个致命而且不能克服的缺点,就是被诱导的产物的对映异构体纯度一般不高。原因在于该试剂结构的本质,因为在与氨基相连的手性碳原子周围缺乏合适的空间位阻 。
常规包装
运输
产品描述
该物质对环境可能有危害,对水体应给予特别注意。
本数据整理信息仅供参考,如有不符,欢迎修改数据
- •L-α-苯乙胺;S-(-)-α-甲基苄胺
.百度百科[引用日期2022年04月27日]
